La cella a combustibile: un’analisi
Sebbene il dispositivo chiamato “pila a combustibile” faccia parte di uno dei propulsori alternativi più impressionanti, il guidatore medio ne sa ancora poco. Uno dei motivi è la scarsa popolarità di questa soluzione e, dall’altra parte, la mancanza di conoscenza della tecnologia utilizzata in essa.
Definizione
Le celle a combustibile sono attualmente utilizzate non solo nell’industria automobilistica, , ma anche in varie altre applicazioni. Questa tecnologia viene impiegata in diverse versioni, tra cui l’industria militare, dai sistemi di riscaldamento a blocchi nelle centrali elettriche, dalla ricerca spaziale e persino dalla microelettronica. In questo articolo ci concentreremo principalmente sull’industria automobilistica, anche se all’inizio vale la pena introdurre il principio generale di funzionamento della cella, per poi passare ad esempi specifici.

La cella a combustibile è un sistema che converte l’energia chimica in elettricità, la quale, sua volta, viene utilizzata per generare energia cinetica nel caso dei veicoli.
L’energia utilizzata nelle celle a combustibile è chiamata energia chimica perché la sua fonte sono i processi chimici.
Tipi fondamentali di cellule
Prima di entrare nei dettagli, è importante menzionare che, sebbene la cella a idrogeno sia una versione della cella a combustibile, questi dispositivi sono invenzioni separate.
Nell’elenco che segue, forniremo una breve descrizione dei più importanti tra di essi.
- AFC, cella elettrolitica alcalina: si tratta di una cella a combustibile utilizzata nell’industria automobilistica che richiede idrogeno e ossigeno per funzionare. La sua temperatura di esercizio è di 80°C, il rendimento teorico è del 70%, che nella pratica si avvicina al 62%.
- PEMFC, Proton Permeable Membrane Cell: Il suo principio di funzionamento è molto simile all’AFC. La temperatura di esercizio è anch’essa di 80°C, ma l’efficienza è inferiore: teoricamente è del 68%, ma in pratica difficilmente raggiunge il 50%. E’ utilizzata trova nell’industria automobilistica, e nei sistemi di riscaldamento a blocchi nelle centrali elettriche.
- DMFC, methanol direct membrane cell: La differenza significativa rispetto alle due precedenti è che il materiale utilizzato non è idrogeno e ossigeno, ma metanolo e ossigeno. Il metanolo è una sostanza più facile da produrre, ma l’efficienza della cella non è elevata: solo il 26%. Nella microelettronica, questo dispositivo viene utilizzato come fonte di alimentazione.
- PAFC, Phosphoric Acid Cell: Questa versione è spesso utilizzata anche come fonte di energia; ha un ottimo rendimento teorico del 65%, in pratica raggiunge il 60%, mentre la sua temperatura di esercizio raggiunge i 200°C. L’elettrolito è acido fosforico concentrato, ma anche il carburante è idrogeno e ossigeno.
- MCFC, cella a sali di carbonato alcalino: Una delle celle dei riscaldatori a turbina a vapore a due stadi. Funziona a 650°C e può essere utilizzato con una varietà di combustibili, dall’idrogeno al gas naturale e dal biogas all’ossigeno. L’efficienza teorica è del 65%, in pratica è di circa il 62%.
- SOFC, cella di ossido di ceramica: questa cella elettrolitica ceramica di ittrio e zirconio è il secondo tipo di cella che si trova nei riscaldatori a turbina a vapore a due stadi. La sua temperatura interna è astronomica, fino a 1000°C, e la gamma di combustibili utilizzati è simile a quella dell’MCFC. I livelli di efficienza sono gli stessi: teorico è del 65% e pratico è del 62%.
Nella parte successiva dell’articolo ci occuperemo delle celle utilizzate nell’industria automobilistica.
Principio di funzionamento
Il processo chimico menzionato in precedenza nelle auto a celle a combustibile è chiamato reazione redox.
Le fasi della produzione di energia possono essere paragonate all’interno di una batteria al piombo: abbiamo un anodo in cui l’idrogeno gassoso viene ossidato. Questa è una parte del processo in cui l’idrogeno dona un elettrone che passa attraverso il circuito esterno al catodo, generando così una corrente elettrica e facendo lavoro elettrico.
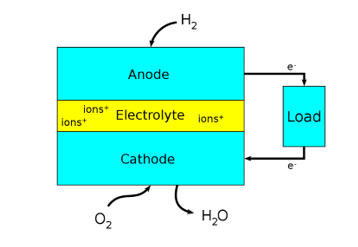
L’altra metà del processo avviene al catodo, dove si verifica una reazione redox. Qui, l’ossigeno, lo ione di idrogeno caricato positivamente precedentemente menzionato e un elettrone si combinano per formare acqua.
Grazie a una serie di catalizzatori, l’idrogeno perde il suo elettrone. La scelta del materiale per l’anodo e il catodo può variare a seconda dell’uso previsto, ad esempio l’elettrodo dell’anodo è spesso realizzato in platino e il catodo in nichel. La transizione degli ioni idrogeno dall’anodo al catodo è possibile grazie all’elettrolita tra i due elettrodi, che lascia passare solo gli ioni, non gli elettroni.
Aspetti dell’industria automobilistica
Sebbene la NASA utilizzi attivamente le celle a combustibile dagli anni ’60, la storia del dispositivo nell’industria automobilistica è molto più giovane. Il fatto è che Chevrolet sviluppò l’Electrovan già nel 1966, ma la produzione di massa non ebbe mai luogo. Nel settembre 1999, Honda ha lanciato la FCX-V1, rendendo l’auto a celle a combustibile disponibile al grande pubblico.

Da allora, molti produttori hanno provato questa soluzione, ma attualmente solo due modelli sono disponibili in produzione in Europa: uno è la Toyota Mirai (2015-) e l’altro è la Hyundai Nexo (2018-). Nel prossimo capitolo discuteremo perché questo elenco è così modesto.
Vantaggi e svantaggi
Le proprietà benefiche della cella a combustibile sono diventate subito chiare ai progettisti:
- nessuna parte in movimento – funzionamento affidabile
- insensibilità alle variazioni di temperatura
- peso leggero, dimensioni compatte
- nessuna emissione nociva
Dal punto di vista dell’industria automobilistica, va inoltre sottolineato che la tecnologia delle batterie nelle auto elettriche consente un’autonomia di guida di circa 600 chilometri. La Toyota Mirai ha già mostrato tali prestazioni nel 2015 e da allora poco è cambiato. Non c’è dubbio che la cella a combustibile ha ancora molto potenziale in questo campo. È anche interessante che il rifornimento di carburante non richieda molto più tempo rispetto a un’auto con motore a combustione interna. Questa è un’altra questione importante oltre alla tecnologia.

- Ora sorge la domanda: perché le celle a combustibile sono così rare?
- Risposta: I suoi vantaggi comportano anche notevoli svantaggi.
- Lo stoccaggio dell’idrogeno è complicato quanto l’elettricità e anche la sua produzione è problematica.
Tuttavia, un problema molto più urgente è che le materie prime delle celle a combustibile sono astronomicamente costose, quindi il veicolo stesso non ha un prezzo competitivo. Il secondo punto critico è la mancanza di infrastrutture di ricarica. Attualmente i paesi europei stanno provvedendo all’installazione di pozzi di idrogeno, ma questo comporta un costo unitario più elevato rispetto all’installazione di stazioni di ricarica per veicoli elettrici.
Risolvendo le ultime due carenze, le auto a celle a combustibile possono conquistare il mercato automobilistico: è interessante vedere quanto velocemente verrà sviluppata questa tecnologia.
Fonte:
- https://www.energy.gov/eere/fuelcells/fuel-cells
- https://mogi.bme.hu/TAMOP/jarmufedelzeti_elektronika/ch09.html
- https://en.wikipedia.org/wiki/List_of_fuel_cell_vehicles
- https://en.wikipedia.org/wiki/Honda_FCX
- https://en.wikipedia.org/wiki/Fuel_cell_vehicle
- http://astro.u-szeged.hu/szakdolg/vegiandras/mukodes/uzemanyagcellak.html
- https://hu.wikipedia.org/wiki/%C3%9Czemanyagcella
- https://en.wikipedia.org/wiki/Fuel_cell_vehicle#/media/File:Toyota_MIRAI_Z_(JPD20)_with_ mounted_option.jpg
- https://en.wikipedia.org/wiki/Fuel_cell_vehicle#/media/File:Hyundai_Nexo_front_4.2.18.jpg
- https://en.wikipedia.org/wiki/Fuel_cell#/media/File:Fuel_Cell_Block_Diagram.svg